小編整理: 氫氣(
英語 :Hydrogen)是氫(H)元素的單質(zhì)形態(tài),化學(xué)式為H2。氫氣在常溫常壓下是一種無色、無味、無毒、易燃易爆炸氣體,分子量為2.0157,在0℃、101.325kPa條件下的密度為0.08987g/L。氫氣難溶于水中,在21℃時(shí),水中溶解度僅為1.62mg/L。氫氣是世界上已知密度最小的氣體,其相對原子質(zhì)量約為2。
因此,答案為:無;無;無;易燃;無;2.
氫氣 氫氣(英語:Hydrogen)是氫(H)元素的單質(zhì)形態(tài),化學(xué)式為H?。氫氣在常溫常壓下是一種無色、無味、無毒、易燃易爆炸氣體,分子量為2.0157,在0 ℃、101.325 kPa條件下的密度為0.08987 g/L。氫氣難溶于水中,在21 ℃時(shí),水中溶解度僅為1.62 mg/L。氫氣是世界上已知密度最小的氣體,也是自然界中最輕的氣體,其具有可燃性、還原性、氧化性等化學(xué)性質(zhì)。氫氣不僅可以用于填充氣球、治療疾病,在工業(yè)上作氫化劑和還原劑,而且它也是21世紀(jì)主要研究的一種新型的清潔能源,可以作為航空燃料或以燃燒電池的方式為汽車提供動(dòng)力。氫氣可以通過 電解水 、水煤氣、烴類轉(zhuǎn)化法等方法制備。
基本信息
物理性質(zhì)
密度
0.08987 g/L(0 ℃,101.325 kPa)
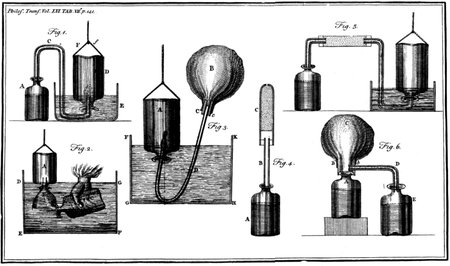
發(fā)現(xiàn)歷史 16世紀(jì), 瑞士 醫(yī)生帕拉賽斯·菲利普斯·奧利奧盧斯(Paracelsus Philippus Aureolus)發(fā)現(xiàn)當(dāng) 鐵 屑投入到硫酸會生成一種氣體,這個(gè)氣體就是氫氣。 17世紀(jì),比利時(shí)科學(xué)家范·海爾蒙特(van Helmont)說過“干餾有機(jī)物會生成可燃?xì)怏w”,該可燃?xì)怏w就是 甲烷 、氫氣、 一氧化碳 的混合物。 17世紀(jì)中葉, 英國 化學(xué)家 羅伯特 (Robert Boyle)將裝滿 稀硫酸 的長頸瓶倒置在同樣盛有硫酸的液面上,將鐵粒投入到大瓶里,一段時(shí)間后,長頸瓶中收集到一種氣體,該氣體即為氫氣。 這些科學(xué)家均未對氫氣有進(jìn)一步的研究。 英國 亨利·卡文迪許 (Henry Cavendish)是歷史上公認(rèn)的氫氣發(fā)現(xiàn)者。1766年,卡文迪許發(fā)表的一篇研究報(bào)告 《論人工空氣》 中描述利用一定量的鐵、 鋅 金屬與足量的酸(如稀硫酸、 稀鹽酸 )反應(yīng)可制得“可燃空氣”(即氫氣)。他利用排水法將該氣體收集起來進(jìn)行了仔細(xì)研究,發(fā)現(xiàn)該氣體與空氣混合后遇火星會爆炸。然而,卡文迪許由于受到燃素說的影響,始終認(rèn)為這種氣體是一種燃素。直到1787年, 法國 化學(xué)家安托萬-洛朗·拉瓦錫(Antoine-Laurent de Lavoisier)正式提出氫是一種元素并對其命名為“hydrogenium”。 1808年,英國物理學(xué)家 約翰·道爾頓 (John Dalton)在前人發(fā)現(xiàn)的基礎(chǔ)上,創(chuàng)立了新的 原子學(xué)說 ,主張用 原子 來解釋各種化學(xué)現(xiàn)象,并且首次在化學(xué)領(lǐng)域引用原子量的概念,認(rèn)為每種元素的原子重量是不變的。1811年, 意大利 化學(xué)家阿莫迪歐·阿伏伽德羅(Amedeo Avogadro)提出分子假說,分子是由原子構(gòu)成的,雙原子分子是由兩個(gè)原子構(gòu)成的,而稀有氣體這類單原子分子則是由單子原子構(gòu)成的。1858年,意大利化學(xué)家斯塔尼斯勞·康尼查羅(Stanislao Cannizzaro)對分子假說進(jìn)行了驗(yàn)證。至此,確定了氫氣是一種雙原子分子組成的單質(zhì)。 卡文迪許進(jìn)行氫氣研究時(shí)使用的儀器
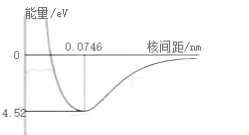
化學(xué)結(jié)構(gòu) H?是H元素的單質(zhì)形態(tài),是最輕的雙原子分子。每一個(gè)H原子在1s原子軌道上有一個(gè)電子,H?分子的成鍵模型可以描述為兩個(gè)H原子分別提供一個(gè)電子形成共價(jià)鍵。當(dāng)兩個(gè)H原子的核間距達(dá)到一定值時(shí),體系能量達(dá)到最小值,此時(shí)平衡距離為0.0746 nm,鍵能為4.52 eV。
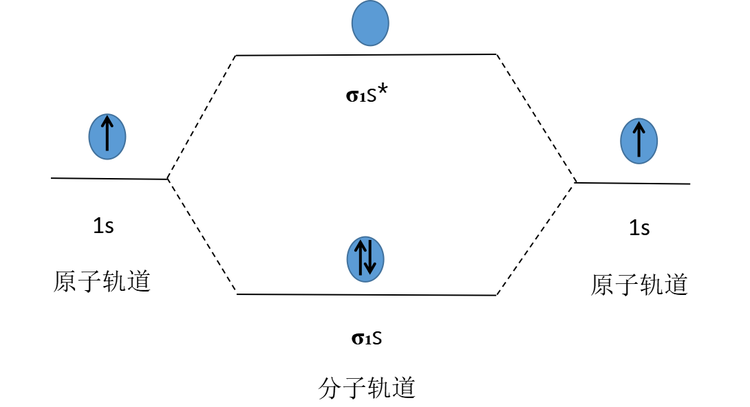
兩個(gè)H原子的1s原子軌道可以線性組合成σ?s(成鍵分子軌道)和σ?s*(反成鍵分子軌道)。當(dāng)電子進(jìn)入成鍵分子軌道時(shí),系統(tǒng)能量降低,電子進(jìn)入反鍵分子軌道時(shí),系統(tǒng)能量升高。兩個(gè)H原子提供的兩個(gè)1s電子會以自旋相反的方式進(jìn)入能量較低的σ?s成鍵分子軌道,形成1個(gè)以σ鍵結(jié)合的H?分子,其分子軌道排布式為H?[(σ?s)2]。
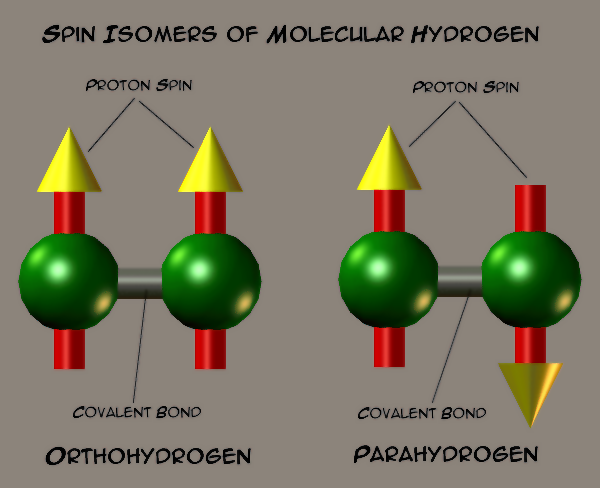
由于原子核的自旋不同,氫氣會形成兩種不同的自旋異構(gòu)體。當(dāng)兩個(gè)原子核自旋方向相同時(shí),為正氫;當(dāng)兩個(gè)原子核自旋方向相反時(shí),為仲氫。氫氣通常是正氫和仲氫的平衡混合物,室溫下,氫氣由75%正氫和25%仲氫構(gòu)成。正氫和仲氫之間可以相互轉(zhuǎn)換,當(dāng)溫度降低時(shí),正氫會轉(zhuǎn)換為仲氫,并釋放出熱量。
理化性質(zhì)
物理性質(zhì) 常溫常壓下,H?是一種無色、無味、無毒的氣體,具有體積小、分子量小、黏度低、抗磁性的特點(diǎn)。在100 kPa時(shí),熔點(diǎn)為-259.2 ℃,沸點(diǎn)為-252.8 ℃,在25 ℃時(shí)的蒸氣壓為1.6×10? kPa,在0 ℃,101.325 kPa的密度為0.08987 g/L,難溶解于水中,在21 ℃時(shí)水中溶解度僅為1.62 mg/L,爆炸極限為4.0%-75.6%。
同素異形體 由于氫元素具有多種同位素(如H、D、T),這使得氫氣的原子組成也會大不相同,其中比較常見的有H?、D?、T?、HD、HT、DT。
表2:氫氣同素異形體的三相點(diǎn)與臨界點(diǎn)
H?
D?
T?
HD
HT
DT
三相點(diǎn)
溫度/K
13.96
18.73
20.62
16.60
17.63
19.71
壓力/kPa
7.3
17.1
21.6
12.8
171.7
19.4
臨界點(diǎn)
溫度/K
32.98
38.35
40.44
35.91
37.13
39.42
壓力/kPa
1.31
1.67
1.85
1.48
1.57
1.77
正常沸點(diǎn)/K
20.39
23.67
25.04
22.13
22.92
24.38
氫有H、H?、H?和金屬氫四種同素異形體。H?是由三個(gè)H原子構(gòu)成的不穩(wěn)定分子,一般化學(xué)反應(yīng)中不能形成,但是可以利用H?轟擊處在基態(tài)的H原子而得到。 H?極易失去電子形成H??離子,H??是最簡單的穩(wěn)定多原子分子,H??廣泛存在于宇宙中,已在 木星 、 天王星 、 土星 等行星 金屬氫是氫另一種不常見的同素異形體,在高壓下,固體氫可以從絕緣相轉(zhuǎn)變?yōu)榻饘賹?dǎo)電相。金屬氫擁有良好的導(dǎo)電性、導(dǎo)熱性以及高密度、高超導(dǎo)轉(zhuǎn)變溫度,并且儲存著巨大的能量。有學(xué)者認(rèn)為木星、土星等行星中存在著金屬氫。
化學(xué)性質(zhì) 氫氣的可燃性
氫氣具有可燃性,能在空氣或 氧氣 中燃燒,發(fā)出淡藍(lán)色的火焰,燃燒中釋放熱量。氫氣的爆炸極限是4.0%-75.6%(體積濃度) ,即氫氣在空氣中的體積濃度在該極限之間時(shí),遇火源就會爆炸,因此氫氣在點(diǎn)燃前需要驗(yàn)純。 氫氣的還原性
氫氣的還原性較強(qiáng),常作為還原劑參與化學(xué)反應(yīng),可以和許多金屬氧化物、鹵化物、鹵素等在加熱、高溫等條件下反應(yīng)。氫氣能夠還原金屬活性在Mn(包括Mn)之后的元素形成的氧化物,而且其還原能力與溫度、氣體流量等條件均有關(guān)系。
氫氣的氧化性
氫氣中的每個(gè)氫原子可以分別獲得一個(gè)電子形成負(fù)氫離子(H?),所以氫氣也具有氧化性。由于氫原子的電負(fù)性比大多數(shù)金屬的電負(fù)性大,可以和 堿金屬 、 堿土金屬 (除Mg、Be外)、部分稀土金屬和過渡金屬相互反應(yīng),生成金屬的氫化物。 堿金屬和堿土金屬(除Mg、Be外)的氫化物均為離子型化合物,常溫下的離子型化合物均為白色晶體,熔沸點(diǎn)較高,其中的H?離子同樣具有還原性。許多過渡金屬還可以與氫形成二元化合物。這些金屬氫化物可以作為一種儲氫材料運(yùn)輸氫氣。
電解熔融的金屬氫化物,在陰極發(fā)生還原反應(yīng)生成金屬固體,陽極發(fā)生氧化反應(yīng)生成氫氣,這一現(xiàn)象可證明金屬氫化物中存在H?離子。
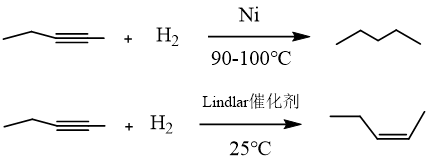
氫氣參與的加成反應(yīng)
氫氣可以與不飽和化合物(如含雙鍵、三鍵、醛基化合物)發(fā)生加成反應(yīng),對于不飽和數(shù)目較多(n≥2)的化合物時(shí),在不同的催化條件下可獲得不同產(chǎn)物。
雙氫配合物
雙氫配合物是包含完整氫分子作為配體的配位化合物。自從1984年首次發(fā)現(xiàn)無解離的雙氫配位以來,已報(bào)道了數(shù)百個(gè)雙氫配合物,如[IrH?(H?)?(PCy?)?]?、Cr(CO)?(H?)?、RuH?(H?)?(PCy?)?、W(CO)?(PCy?)?(H?)等。雙氫配合物大多數(shù)都是過渡金屬離子形成配合物。
制備方法
實(shí)驗(yàn)室制氫方法 ②金屬與酸的反應(yīng),常用金屬Zn、Fe與稀鹽酸反應(yīng)。金屬純度越高,反應(yīng)則越慢。若金屬中有含S、P的雜質(zhì),則會生成H?S、PH?刺激性有毒氣體。
③金屬(如金屬Al、Zn)與強(qiáng)堿的反應(yīng)。
④金屬氫化物與水的反應(yīng),氫化物L(fēng)iH、CaH?、NaBH?等與適量的水反應(yīng)可生成氫氣。
⑤實(shí)驗(yàn)室規(guī)模電解水,在直流電作用下,水分解為氫氣和氧氣。
工業(yè)制氫方法 工業(yè)制氫的方法非常多,主要有以下幾種:
電解水法
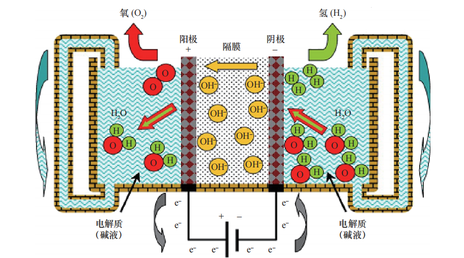
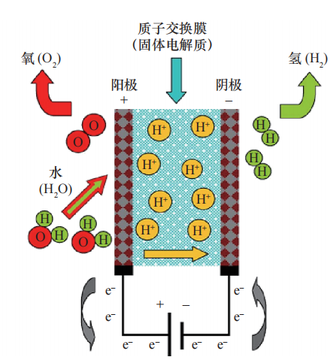
電解水制氫技術(shù)是通過電能,將水分解為純氫氣和氧氣,通常情況下,氫氣在陰極析出。電解法可根據(jù)電解質(zhì)的不同,分為堿性溶液電解法和固體聚合物水電解法。堿性溶液電解技術(shù)是利用KOH或NaOH水溶液為電解質(zhì),這兩種堿性溶液為強(qiáng)電解質(zhì)溶液可增加溶液的電導(dǎo)性,隔膜采用石棉網(wǎng)或者高分子材料。與堿性溶液電解法不同的是,固體聚合物水電解法是以固體聚合物作電解質(zhì),利用質(zhì)子交換膜作為隔膜,具有高效率、綠色環(huán)保等優(yōu)點(diǎn),減少了強(qiáng)堿溶液的使用與浪費(fèi)。
電極反應(yīng)如下:
除直接電解水外,電解飽和食鹽水(氯堿工業(yè))也可得到副產(chǎn)品氫氣。
烴類轉(zhuǎn)換法
目前,世界上大多數(shù)氫氣通過 天然氣 、 丙烷 、 石腦油 等這些烴類混合物重整制得。在高溫蒸氣或部分氧化工藝工程中,烴類化合物在1250-1500 ℃下被分解成H?、CO?、CO。烴類蒸汽轉(zhuǎn)換方法是目前工業(yè)方法中最常用的方法,產(chǎn)率高達(dá)70%-90%。不僅如此,天然氣(主要成分為甲烷)還可以在催化劑作用下直接裂解得到氫氣。 水煤氣法
水煤氣法是先在隔絕空氣的條件下制取焦炭,然后焦炭與水蒸氣在高溫條件下反應(yīng)制得H?。所生成的CO,可以凈化后與水蒸氣在催化下反應(yīng),再次得到H?。氣化主要反應(yīng)如下:
生物制氫
生物制氫可以分為生物法制氫和生物質(zhì)氣化制氫兩種方式。
生物法制氫包含光合生物制氫和生物發(fā)酵制氫。光合細(xì)菌和藻類可在光照厭氧或好氧黑暗條件下,代謝有機(jī)物過程中產(chǎn)生H?。腸桿菌屬、梭菌屬、埃希氏腸桿菌屬等菌體可利用厭氧發(fā)酵將碳水化合物轉(zhuǎn)化為H?。
生物質(zhì)氣化制氫是將生物質(zhì)中的各種有機(jī)物溶解成液體,然后在高溫高壓的條件下,使液體氣化,最終得到H?、CO、少量CO?、H?O和烴。在氣化過程中,可加入催化劑加速過程。相比于烴類轉(zhuǎn)化法,幾乎不會產(chǎn)生含硫等有害氣體,所造成的空氣污染較小。而且生物質(zhì)灰分含有一定的鉀,可以作為肥料使用。
甲醇轉(zhuǎn)化法
蒸汽轉(zhuǎn)化法
甲醇可以在Cu-Zn-Cr催化劑、轉(zhuǎn)化溫度240-260 ℃、壓力0.8-1.0 MPa的條件下反應(yīng),原料甲醇幾乎可以完全轉(zhuǎn)化為H?和CO?。
甲醇直接熱裂解
甲醇直接熱裂解是早期的技術(shù),采用Mo-Ni或Ni-Al催化劑,反應(yīng)溫度400-500 ℃,產(chǎn)品主要為CO和H?。但若要制純氫,粗制的氣體還需通過一氧化碳變換、脫碳、純化等工藝過程。
光催化制氫
光催化制氫是利用太陽能光能在半導(dǎo)體催化下分解水制得氫氣。半導(dǎo)體光催化劑可以從光譜中吸收光子,激發(fā)電子躍遷產(chǎn)生能量,使吸附在其表面的水發(fā)生裂解。目前大多數(shù)的半導(dǎo)體光催化劑為do、d1o電子構(gòu)型的金屬的氧化物、硫化物、氮化物,如TiO?,是目前研究最廣泛半導(dǎo)體光催化劑,具有廉價(jià)、無腐蝕性、穩(wěn)定、環(huán)保等優(yōu)點(diǎn)。
儲存方式 氫氣是一種新型清潔綠色能源,但氫氣在常溫常壓下儲存和運(yùn)輸都較為困難,有泄漏的風(fēng)險(xiǎn),因此可以采用高壓氣態(tài)和低溫液態(tài)的方式儲存氫氣。從20世紀(jì)70年代起,科學(xué)家發(fā)現(xiàn)某些材料可以可逆吸收和釋放氫氣,這類材料被稱為儲氫材料,也可以用于儲存氫氣。
高壓氣態(tài)儲氫 氫氣可以在高壓(一般儲氫壓力為12-15 MPa,有的可高達(dá)20M Pa)裝進(jìn)氣體瓶中,通過減壓閥控制氫氣的釋放。該方法具有成本低、能耗低、充放氫速度快等優(yōu)點(diǎn),是如今最常用的儲氫方式,鋼瓶通常都是耐壓厚重,而且由于常在高壓的環(huán)境下,容易造成氫脆,使得鋼瓶內(nèi)部出現(xiàn)裂縫,有泄露氫氣的潛在危險(xiǎn)。現(xiàn)如今,為解決厚重容器的問題,已研發(fā)多種新型輕質(zhì)氣瓶:纖維環(huán)向纏繞鋼瓶、金屬內(nèi)膽纖維全纏繞復(fù)合材料氣瓶、全復(fù)合輕質(zhì)纖維纏繞儲氫氫罐等。
低溫液態(tài)儲氫 氫氣在熔點(diǎn)-沸點(diǎn)溫度區(qū)間時(shí),氫氣會以液態(tài)的形式存在,因此可以使用液氫儲存。液氫儲存質(zhì)量小、體積小、密度高、純度高,是一種理想的儲氫方式,但是該儲氫技術(shù)的液化過程耗能大、易揮發(fā),為了保持低溫、防止液氫揮發(fā),需要花費(fèi)較大的成本制造儲氫裝置,所以該儲氫技術(shù)目前基本只用于航天航空行業(yè)。
儲氫材料 以上兩種傳統(tǒng)方式雖然具有充放氫速度較快的優(yōu)點(diǎn),但所需厚重的耐壓容器或耗能較高,而運(yùn)輸過程中也有氫氣泄露的安全隱患,因此,人們研發(fā)出了一系列性能較好的儲氫材料。
碳納米管
碳納米管又名巴基管,有單層或多層石墨片卷曲360°而成的無縫、中空納米管,由于碳納米管的尺寸較小,具有較大的比表面,穩(wěn)定性能好,氫可以填充到碳納米管的管體內(nèi)部以及碳納米管束之間的孔隙,因此被認(rèn)為是一種非常有前景的儲氫材料。通過對碳納米管的研究發(fā)現(xiàn),只有使用合適的原料(如CO)得到的碳納米管在常溫常壓下才可以吸附氫氣,而且可以通過改善其晶體結(jié)構(gòu)或摻雜其他金屬來提高儲氫能力。
MOFs材料
金屬-有機(jī)配位聚合物(Metal Organic Frameworks,簡稱MOFs)是無機(jī)金屬中心與多齒狀有機(jī)配體鍵合而成的晶態(tài)材料,具有永久孔隙、高度規(guī)則的孔道結(jié)構(gòu)、孔徑尺寸可調(diào)、表面結(jié)構(gòu)易修飾等優(yōu)點(diǎn),即使除去客體分子,仍能保持骨架 金屬氫化物
由于氫的電負(fù)性較強(qiáng),易與堿金屬、稀土金屬等金屬形成氫化物,可以把氫以這種形式儲存到合金中。LiBH?、LaNi?H?、MgH?、NaAlH?因其熱穩(wěn)定性能好、可逆充放氫、吸振性、可回收性被廣泛用作儲氫材料。在一定溫度和壓力下,把它們放置在氫氣氛中時(shí),就可吸收大量的氫氣,生成金屬氫化物在加熱條件下又釋放出氫。
應(yīng)用領(lǐng)域
氫能源 氫氣能是一種綠色環(huán)保的能源,具有高能量密度且易儲存運(yùn)輸?shù)葍?yōu)點(diǎn),發(fā)展氫能技術(shù)對于構(gòu)建清潔低碳、改善大氣環(huán)境質(zhì)量、推動(dòng)新型能源發(fā)展有重要意義,一些國家已經(jīng)將氫能列為國家能源體系中的重要組成部分。氫能可應(yīng)用于燃料電池領(lǐng)域,燃料電池是將氫氣的化學(xué)能直接轉(zhuǎn)化為電能的裝置,在轉(zhuǎn)化過程中不排放CO?和NOx,對大氣不造成污染,是最佳的氫能利用技術(shù),具有轉(zhuǎn)換效率高、零排放等特點(diǎn)。
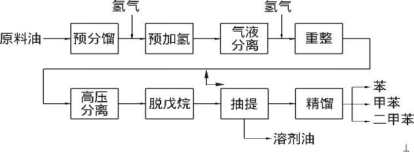
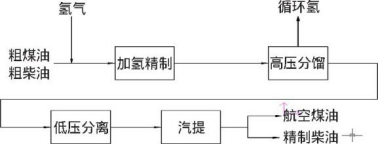
氫化劑 氫氣是化工企業(yè)提高輕油收率、改善產(chǎn)品質(zhì)量的原料,成熟的化石能源清潔利用技術(shù)對氫氣的需求量巨大,其中包括煉油化工過程中的催化重整、加氫裂化、加氫精制。加氫精制是在高溫高壓催化劑的條件下,往油品中加入氫,使氫與油品中的非烴類化合物等雜質(zhì)發(fā)生反應(yīng),從而達(dá)到精制。其中催化重整過程也會生成副產(chǎn)物氫氣,這使得氫源在煉油廠中可循環(huán)利用。不僅如此,煤清潔利用過程中的煤加氫氣化、煤制油直接液化等工藝過程中也需要用到氫氣。
合成工業(yè)級化合物 氫氣可以作為 氨 、 鹽酸 、 甲醇 等多種工業(yè)產(chǎn)品的合成原料。氫氣可以通過Haber-Bosch法在高溫高壓催化劑的條件下固定氮生成氨,氨是制作植物肥料、硝酸及硝酸鹽重要原料之一。 由于氫氣具有可燃性,與氯氣可發(fā)生燃燒反應(yīng),生成氯化氫氣體,溶于水制得鹽酸。
氫氣與一氧化碳可以制備粗甲醇,粗甲醇再經(jīng)過精餾和化學(xué)處理提純。
醫(yī)療領(lǐng)域 氫是一種尚未在醫(yī)學(xué)廣泛使用的物質(zhì),但經(jīng)研究發(fā)現(xiàn),它可以應(yīng)用于多種疾病的治療。氫擁有較強(qiáng)穿透性和極強(qiáng)的自由擴(kuò)散能力,可以快速通過細(xì)胞膜并在體內(nèi)擴(kuò)散。再加上氫較強(qiáng)的還原性,使其具有選擇 氫氣在癌癥治療中的作用
氫氣不僅可以緩解常規(guī)化療藥物引起的副作用,也可以抑制癌細(xì)胞的生長。在化療期間,體內(nèi)會產(chǎn)生過量的活性氧(ROS),由于其高反應(yīng)活性,會攻擊細(xì)胞中的蛋白質(zhì)、脂質(zhì)等,導(dǎo)致細(xì)胞損傷或凋亡,氫氣可以調(diào)節(jié)某些能消除ROS的抗氧化酶。前期氫氣會使ROS水平下降 氫氣對器官缺血再灌注損傷的保護(hù)作用
缺血再灌注(Ischemia-Reperfusion)損傷是組織或器官在缺血的基礎(chǔ)上,由于血液和氧氣重新供應(yīng)所發(fā)生的不可逆性損傷。2007年,日本科學(xué)家Oshawa等人發(fā)現(xiàn)氫可以通過選擇性地減少細(xì)胞毒性的羥基自由基(·OH),作為一種治療性抗氧化劑保護(hù)神經(jīng)元,改善腦缺血再灌注損傷。
經(jīng)不斷地研究可知,氫對心臟、肺、肝、腸和腎的缺血再灌注損傷均有器官保護(hù)功能,因?yàn)闅錃饩哂锌寡趸芰Γ梢詼p少體內(nèi)的自由基或ROS,抑制氧化應(yīng)激反應(yīng),從而保護(hù)組織免受損壞。
氫氣在腎病治療中的作用
順鉑是治療癌癥廣泛使用的一種化合物,但順鉑的大量使用可能會造成腎毒性。然而吸入氫氣或者飲用含氫水,可以對順鉑有保護(hù)作用,改善由順鉑引起的腎功能不全。富氫鹽水對II型糖尿病也具有良好的治療效果,不僅可以改善患者的胰島素抵抗、促進(jìn)脂類和葡萄糖的代謝,而且可以緩解糖尿病所引起的腎臟炎癥反應(yīng)。
安全事宜
危險(xiǎn)性 氫氣是極端易燃?xì)怏w,與空氣混合能形成爆炸性混合物,遇熱或明火即發(fā)生爆炸。在鉑及其它金屬催化劑上,氫氣和氧氣在常溫下即能發(fā)生爆炸反應(yīng)。與氧化劑、鹵素( 氟 、氯、 溴 、 碘 )、乙炔、氧化氮等化合物接觸后,在一定條件下會劇烈反應(yīng),甚至爆炸。所以需要避免在靜電、熱、潮濕的環(huán)境下儲存,不能與強(qiáng)氧化劑、鹵素等物品接觸。
消防相關(guān) 由氫氣引發(fā)的火災(zāi)應(yīng)用水霧、干粉、泡沫或二氧化碳滅火劑滅火。避免使用直流水滅火,直流水可能導(dǎo)致可燃性液體的飛濺,使火勢擴(kuò)散。當(dāng)火災(zāi)發(fā)生時(shí),應(yīng)迅速切斷氣源。若不能立即切斷氣源,則不能熄滅泄漏處的火焰,應(yīng)噴水冷卻燃燒容器和臨近容器,盡可能將容器從火場移至空曠處,防止容器受熱爆炸。
急救措施 當(dāng)吸入少量氫氣時(shí),應(yīng)立即轉(zhuǎn)移至新鮮空氣處。皮膚和眼睛與液氫接觸凍傷時(shí),用大量水沖洗,沖洗后立即前往醫(yī)院。當(dāng)不小心誤食時(shí),立即漱口,禁止催吐,并前往醫(yī)院就醫(yī)。