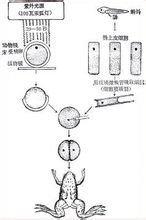
受體細(xì)胞去核
作為細(xì)胞核移植的受體細(xì)胞主要有三類:去核的卵母細(xì)胞、受精卵和2-細(xì)胞胚胎,其中卵母細(xì)胞應(yīng)用最為廣泛。有人用兩個(gè)去核卵母細(xì)胞融合后產(chǎn)生的胞質(zhì)作為受體進(jìn)行各代核移植,以增核移植胚胎的細(xì)胞數(shù)和提高繼代移植效率。研究證明,體外成熟培養(yǎng)的卵母細(xì)胞核移植成功率不如體內(nèi)成熟的卵母細(xì)胞,其原因可能是卵母細(xì)胞在體外成熟過程中,需要合成一些蛋白質(zhì)來完成第一次減數(shù)分裂,體外成熟的一些卵母細(xì)胞其活動(dòng)有可能受到抑制。 2.1卵母細(xì)胞的去核方法
2.1.1盲吸法用微細(xì)玻璃管在第一極體下盲吸,吸除第一極體及處于分裂中期的染色體和周圍的部分細(xì)胞質(zhì),但該方法成功率低。為提高去核率,利用Hoechst33342染料對(duì)染色質(zhì)的特異性染色作用,在熒光顯微鏡下去核后判斷去核是否完成,去核準(zhǔn)確率大為提高。Stice等用Hoechst33342(1μg/ml)染色,在紫外線下照射的時(shí)間控制在10s以內(nèi),未觀察到對(duì)胚胎發(fā)育的負(fù)面影響。 2.1.2半卵法用微細(xì)玻管針在透明帶上做一切口后,用微細(xì)玻管吸去一半染色質(zhì)至另一半空透明帶內(nèi),即將卵母細(xì)胞分為兩半,然后用Hoechst33342染色,確定不含染色體的一半為細(xì)胞質(zhì)受體。其操作方法如下,將卵母細(xì)胞移入35mm含有mPBSA(磷酸緩沖液,其中有D-葡萄糖1000mg/l、丙酮酸36mg/l、0.4%牛血清白蛋白、1%青霉素和鏈霉素10000μg/ml)的皮氏培養(yǎng)皿中進(jìn)行顯微操作,首先分兩步進(jìn)行分割透明帶,即先在透明帶上切一小口,然后用另一切割針擴(kuò)大切口,從而分割透明帶。透明帶被切除后轉(zhuǎn)移到含有mPBSA+5μg/ml細(xì)胞松弛素B的35mm的皮氏培養(yǎng)皿中作用3一5min,然后用固定針(內(nèi)徑為透明帶的l/5一1/3,外徑接近透明帶的直徑)固定,分割針進(jìn)入透明帶的隙口中并將該針固定在靠著透明帶的地方,緩慢吸取卵母細(xì)胞液,當(dāng)分割針中吸取了一半卵母細(xì)胞液時(shí),這時(shí)將該針從卵黃隙中移出,并靠著透明帶切割邊緣輕微地擦過以達(dá)到完全的分割,將其針中的卵母細(xì)胞液移入準(zhǔn)備好了的空透明帶中,并用Hoechst33342染色,熒光顯微鏡下觀察不發(fā)熒光的作為受體卵母細(xì)胞。 2.1.3離心去核Tatham等以15000g、2min離心牛卵母細(xì)胞,用鏈霉蛋白酶去除卵母細(xì)胞透明帶(ZP),經(jīng)滲透壓梯度離心,MⅡ期紡錘體可從大多數(shù)卵母細(xì)胞中分開,把無透明帶的去核胞質(zhì)作核移植的供質(zhì),同分裂球聚集經(jīng)電融合成核移植胚,最后放入藻酸鈉假透明帶中,能在體外卵裂和發(fā)育,但其效果還有待于進(jìn)一步研究。 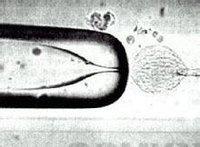
核移植
多數(shù)研究者在多數(shù)卵母細(xì)胞出現(xiàn)第一極體的成熟時(shí)期去核,去核時(shí)間,體內(nèi)成熟在發(fā)情開始后48h,體外成熟22-24h。卵母細(xì)胞去核程序與重構(gòu)胚中再程序化狀況密切相關(guān),去核率越高,其克隆胚最終發(fā)育成正常胚的可能性越大。去核率的高低與卵母細(xì)胞所處的成熟時(shí)期以及所采用的方法密切相關(guān)。以前的核移植研究均采用未激活的卵母細(xì)胞作為核受體,并認(rèn)為激活后卵母細(xì)胞的重排能力會(huì)下降,影響核移植的效率。但Ushijima,等和Terlovw等;研究表明,激活后的卵母細(xì)胞作為核供體時(shí),重構(gòu)胚融合和發(fā)育能力均優(yōu)于融合激活同時(shí)進(jìn)行的效果。 2.3 胞質(zhì)容士與重構(gòu)胚的發(fā)育潛力
有人對(duì)核反比例與重構(gòu)胚發(fā)育的關(guān)系進(jìn)行研究,結(jié)果表明,卵母細(xì)胞去除的胞質(zhì)量與預(yù)期供核體積大小相當(dāng)時(shí),可以為細(xì)胞周期的相互作用創(chuàng)造最好的條件,而去除太少或太多并不理想。基于去除細(xì)胞質(zhì)的量與去核率關(guān)系切,因此,在保證有較高的去核情況下。去除的胞質(zhì)應(yīng)盡量少。